
Conçu pour induire une réponse
LYTGOBI a reçu une autorisation de mise sur le marché conditionnelle de l’Agence Européenne des Médicaments1
Cela signifie que des preuves supplémentaires pour confirmer l’efficacité et la sécurité de ce médicament sont attendues1
LYTGOBI a montré un taux de réponse objective (TRO) de 42 % chez les patients atteints de CCAi localement avancé ou métastatique précédemment traités1
TRO : 42 %

Délai médian de réponse de 2,5 mois (plage : 0,7-7,4)
Le TRO pour LYTGOBI était de
42 %
(IC à 95 % : 32 %, 52 %)
RP : 42 %
Les patients ont présenté une durée de réponse médiane (DRm) de près de 10 mois avec LYTGOBI1
DR médiane
9,7
Mois
(IC à 95 % : 7,6, 17,1)


Median DoR
9.7
Months
(95% CI: 7.6-17.1)
| Estimations de Kaplan-Meier de la DRm (IC à 95 %) | Population évaluable pour l’efficacité (N = 103) |
|---|---|
| 3 mois | 100 % (100, 100) |
| 6 mois | 85,1 % (69,8, 93,1) |
| 9 mois | 52,8 % (34,2, 68,3) |
| 12 mois | 37,0 % (18,4, 55,7) |
FOENIX-CCA2 : Critères d’évaluation supplémentaires
Survie sans progression (SSP)2
Estimation de Kaplan-Meier de la SSP (N = 103)
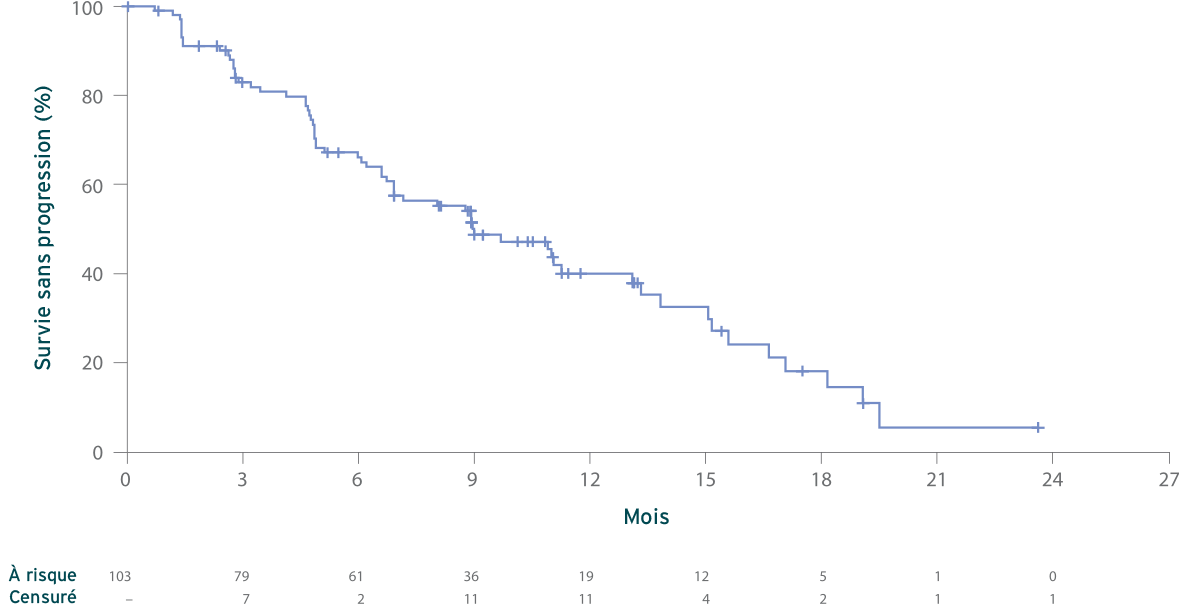
Médiane, 9,0 mois (IC à 95 % : 6,9, 13,1)
- Le suivi médian à la date limite de collecte des données était de 17,1 mois
Survie globale (SG)2
Estimation de Kaplan-Meier de la SG (N = 103)
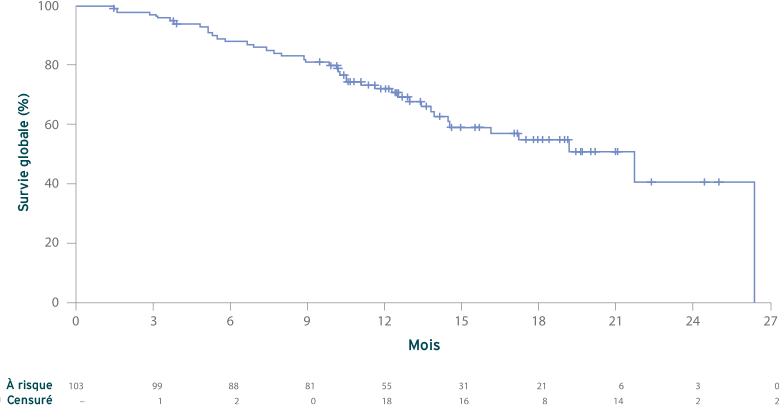
Médiane, 21,7 mois (IC à 95 % : 14,5, non atteinte)
- À la date limite de collecte des données (1 octobre 2020) : Le suivi médian était de 17,1 mois ; les données de SG n’étaient pas matures ; 40 patients sont décédés. Tous les patients avaient arrêté le traitement avant leur décès, la raison principale de l’arrêt étant la progression de la maladie chez 90 % des patients.2
- L’analyse mature avec un suivi médian de 25,0 mois (29 mai 2021) a rapporté une SG médiane de 20,0 mois (IC à 95 % : 16,4-24,6)2
Taux de contrôle de la maladie (TCM) (n = 85)2

- FOENIX-CCA2 était une étude à bras unique2
- Dans ce contexte, les résultats du TCM peuvent refléter l’histoire naturelle du cholangiocarcinome chez un patient donné, plutôt que l’effet direct du traitement
- *Le TCM est la somme des réponses complètes, partielles et maladies stables.
Résultats supplémentaires
Résultats d’efficacité lors du suivi prolongé
Lors d’une analyse de suivi non prédéfinie menée 8 mois après l’analyse principale (date limite de collecte des données, 29 mai 2021 ; suivi médian, 25,0 mois), l’efficacité dans la population globale de l’étude s’est maintenue avec2:
- un TRO de 41,7 % avec IC à 95 %, 32,1 à 51,9
- un TCM de 82,5 % avec IC à 95 %, 73,8 à 89,3
- une DR médiane de 9,5 mois avec IC à 95 %, 7,6 à 10,4
- une SSP médiane de 8,9 mois avec IC à 95 %, 6,7 à 11,0
- une SG médiane de 20,0 mois avec IC à 95 %, 16,4 à 24,6
CCAi = cholangiocarcinome intrahépatique ; DR = durée de la réponse ; IC = intervalle de confiance ; RP = réponse partielle ; SG = survie globale ; SSP = survie sans progression ; TCM - taux de contrôle de la maladie ; TRO = taux de réponse objective.
Références :
Résumé des caractéristiques du produit de LYTGOBI®. www.lytgobi.eu/fr/smpc
2.Goyal L, et al. Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma. N Engl J Med. 2023;388:228—239.


